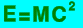
Todas las relaciones termodinámicas
importantes empleadas en ingeniería se derivan del primer y segundo principios
de la termodinámica. Resulta útil tratar los procesos termodinámicos basándose
en ciclos: procesos que devuelven un sistema a su estado original después de una
serie de fases, de manera que todas las variables termodinámicas relevantes vuelven
a tomar sus valores originales. En un ciclo completo, la energía interna de un
sistema no puede cambiar, puesto que sólo depende de dichas variables. Por tanto,
el calor total neto transferido al sistema debe ser igual al trabajo total neto
realizado por el sistema.
Un motor térmico de eficiencia
perfecta realizaría un ciclo ideal en el que todo el calor se convertiría en trabajo
mecánico. El científico francés del siglo XIX Sadi Carnot, que concibió un ciclo
termodinámico que constituye el ciclo básico de todos los motores térmicos, demostró
que no puede existir ese motor perfecto. Cualquier motor térmico pierde parte
del calor suministrado. El segundo principio de la termodinámica impone un límite
superior a la eficiencia de un motor, límite que siempre es menor del 100%. La
eficiencia límite se alcanza en lo que se conoce como ciclo de Carnot. Tercer
principio de la termodinámica El
segundo principio sugiere la existencia de una escala de temperatura absoluta
con un cero absoluto de temperatura. El tercer principio de la termodinámica afirma
que el cero absoluto no puede alcanzarse por ningún procedimiento que conste de
un número finito de pasos. Es posible acercarse indefinidamente al cero absoluto,
pero nunca se puede llegar a él.
Fundamentos microscópicos
de la termodinámica El descubrimiento
de que toda la materia está formada por moléculas proporcionó una base microscópica
para la termodinámica. Un sistema termodinámico formado por una sustancia pura
puede describirse como un conjunto de moléculas iguales, cada una de las cuales
tiene un movimiento individual que puede describirse con variables mecánicas como
la velocidad o el momento lineal. En ese caso, debería ser posible, al menos en
principio, calcular las propiedades colectivas del sistema resolviendo las ecuaciones
del movimiento de las moléculas. En ese sentido, la termodinámica podría considerarse
como una simple aplicación de las leyes de la mecánica al sistema microscópico. Los
objetos de dimensiones normales, a escala humana, contienen cantidades inmensas
de moléculas (del orden de 1024). Suponiendo que las moléculas fueran esféricas,
harían falta tres variables para describir la posición de cada una y otras tres
para describir su velocidad. Describir así un sistema macroscópico sería una tarea
que no podría realizar ni siquiera la mayor computadora moderna. Además, una solución
completa de esas ecuaciones nos diría dónde está cada molécula y qué está haciendo
en cada momento. Una cantidad tan enorme de información resultaría demasiado detallada
para ser útil y demasiado fugaz para ser importante. Por
ello se diseñaron métodos estadísticos para obtener los valores medios de las
variables mecánicas de las moléculas de un sistema y deducir de ellos las características
generales del sistema. Estas características generales resultan ser precisamente
las variables termodinámicas macroscópicas. El tratamiento estadístico de la mecánica
molecular se denomina mecánica estadística, y proporciona a la termodinámica una
base mecánica. Desde la perspectiva
estadística, la temperatura representa una medida de la energía cinética media
de las moléculas de un sistema. El incremento de la temperatura refleja un aumento
en la intensidad del movimiento molecular. Cuando dos sistemas están en contacto,
se transfiere energía entre sus moléculas como resultado de las colisiones. Esta
transferencia continúa hasta que se alcance la uniformidad en sentido estadístico,
que corresponde al equilibrio térmico. La energía cinética de las moléculas también
corresponde al calor, y, junto con la energía potencial relacionada con las interacciones
entre las moléculas, constituye la energía interna de un sistema. La
conservación de la energía, una ley bien conocida en mecánica, se transforma en
el primer principio de la termodinámica, y el concepto de entropía corresponde
a la magnitud del desorden a escala molecular. Suponiendo que todas las combinaciones
de movimientos moleculares son igual de probables, la termodinámica demuestra
que cuanto más desordenado sea el estado de un sistema aislado, existen más combinaciones
que pueden dar lugar a ese estado, por lo que ocurrirá con una frecuencia mayor.
La probabilidad de que se produzca el estado más desordenado es abrumadoramente
mayor que la de cualquier otro estado. Esta probabilidad proporciona una base
estadística para definir el estado de equilibrio y la entropía. Por
último, la temperatura puede disminuirse retirando energía de un sistema, es decir,
reduciendo la intensidad del movimiento molecular. El cero absoluto corresponde
al estado de un sistema en el que todos sus componentes están en reposo. Sin embargo,
este concepto pertenece a la física clásica. Según la mecánica cuántica, incluso
en el cero absoluto existe un movimiento molecular residual. Un análisis de la
base estadística del tercer principio se saldría de los límites de esta discusión. Fotoeléctrico,
Efecto, formación y liberación de partículas eléctricamente cargadas que se produce
en la materia cuando es irradiada con luz u otra radiación electromagnética. El
término efecto fotoeléctrico designa varios tipos de interacciones similares.
En el efecto fotoeléctrico externo se liberan electrones en la superficie de un
conductor metálico al absorber energía de la luz que incide sobre dicha superficie.
Este efecto se emplea en la célula fotoeléctrica, donde los electrones liberados
por un polo de la célula, el fotocátodo, se mueven hacia el otro polo, el ánodo,
bajo la influencia de un campo eléctrico. El
estudio del efecto fotoeléctrico externo desempeñó un papel importante en el desarrollo
de la física moderna. Una serie de experimentos iniciados en 1887 demostró que
el efecto fotoeléctrico externo tenía determinadas características que no podían
explicarse por las teorías de aquella época, que consideraban que la luz y todas
las demás clases de radiación electromagnética se comportaban como ondas. Por
ejemplo, a medida que la luz que incide sobre un metal se hace más intensa, la
teoría ondulatoria de la luz sugiere que en el metal se liberarán electrones con
una energía cada vez mayor. CELDAS
SOLARES Estas celdas casi siempre
se hacen de una capa de silicio, un elemento no metalico muy comun, que recubre
una base metalica conocida como sustrato, el silicio se trata quimicamente para
producir las formas llamadas tipo p y tipo n. El area donde estas dos formas se
tocan se denomina juntura p-n. La
seccion transversal de una celda solar de silicio se muestra en la figura 81-1
. La capa superior de silicio tipo p es muy delgada. La energia luminosa suministra
energia a los electrones en la capa tipo p y por tal motivo estoa traviesan la
juntura p-n hasta llegar a la capa tipo n . Por consiguiente , la capa tipo n
queda cargada negativamente . Un voltaje se produce entre las capas de cada lado
de la juntura p-n. La cantidad de
voltaje producido por una sola celda solar, muchas celdas para formar un panel
solar.Un uso muy importante para de los paneles solares es proporcionar energia
para cargas baterias y circuitos de trabajo en vehiculos especiales.
|